

![]() Radioaktivität
Radioaktivität
![]() Geigerzähler
Geigerzähler
![]() Weitere Geräte
Weitere Geräte
![]() Bedeutung
Bedeutung
1.1 Grundlagen
Bestimmt kennen Sie aus den erwähnten Medienberichten alle Begriffe wie "Atomkraftwerk" oder "Kernkraft" und haben auch schon gehört, dass sie mit dem Thema Radioaktivität eng verknüpft sind. Die radioaktive Strahlung muss also mit dem Atom zu tun haben, und zwar insbesondere mit dem Kern des Atoms.
Um zu verstehen, was Radioaktivität ist, müssen Sie zunächst einmal wissen, wie ein Atom aufgebaut ist. Die Atome aller Elemente bestehen aus drei unterschiedlichen Arten von Bausteinen. Protonen, Neutronen und Elektronen. Die Protonen und Neutronen bilden gemeinsam den Kern eines jeden Atoms, die Elektronen seine Hülle. Während die Protonen und Neutronen für den Großteil des Atomgewichts verantwortlich sind, rührt die räumliche Ausdehnung fast ausschließlich von den Elektronen her.
Elektronen sind elektrisch negativ geladene Teilchen, während die Protonen positiv geladen sind. Durch die Anziehungskräfte zwischen positiven und negativen Ladungen wird das Atom zusammengehalten. Die Anzahl der Protonen bestimmt, zu welchem Element ein Atom gehört. Im elementaren Zustand sind gleich viele Protonen und Elektronen vorhanden. Die Neutronen sind, wie man dem Namen schon anmerken kann, elektrisch neutrale Teilchen. Sie befinden sich ebenfalls im Atomkern und verringern dort die Abstoßung zwischen den positiv geladenen Protonen.
Chemische Reaktionen zwischen unterschiedlichen Elementen spielen sich ausschließlich innerhalb der Elektronenhülle ab, der Kern des Atoms bleibt dabei unverändert.
Anders jedoch beim radioaktiven Zerfall. Dieser führt direkt im Atomkern zu Veränderungen, so dass Elemente bei Abgabe von radioaktiver Strahlung in andere Elemente überführt werden.
Beim radioaktiven Zerfall unterscheidet man verschiedene Zerfallsarten, bei denen unterschiedliche Arten von Strahlung abgegeben werden. Die drei wichtigsten möchte ich Ihnen im Folgenden vorstellen.
Wenn Atomkerne α-Strahlung abgeben, stoßen sie Heliumkerne ab, also Teilchen, die aus zwei positiv geladenen Protonen und zwei Neutronen bestehen. Die Ordnungszahl des Elements verringert sich bei diesem Prozess um zwei. Da die α-Teilchen relativ groß sind, ist ihre Durchdringungsfähigkeit gering. α-Strahler werden hauptsächlich dann gefährlich, wenn sie in den Körper aufgenommen werden, beispielsweise über die Atemwege oder durch kontaminierte Nahrung. 3.5 cm Abstand reichen aus, um der Reichweite der α-Strahlung zu entgehen.
Gelangen α-Teilchen aber doch in den Körper, sind sie sehr gefährlich, weil sie sich mit vorhandenen Atomen zu weiteren instabilen, also radioaktiven, Teilchen verbinden können, die im Körper weiter zerfallen.
Die β-Strahlung besteht aus einzelnen Elektronen. In Elementen, die β-Strahlung abgeben, zerfällt ein Neutron in ein negativ geladenes Elektron und ein positiv geladenes Proton. Bei diesem Prozess erhöht sich die Ordnungszahl des Elements um 1.
β-Strahlung besitzt bereits eine deutlich höhere Reichweite und Durchdringungsfähigkeit als die α-Strahlung, ihre Reichweite beträgt 4 m. Die Gefahr bei der β-Strahlung besteht darin, dass die freigesetzten Elektronen ungeladene Teilchen in negativ geladene Ionen umwandeln können.
Im Falle der γ-Strahlung haben wir es nicht mit abgegebenen Kernbruchstücken zu tun, sondern mit energiereicher, elektromagnetischer Strahlung. Diese Strahlung wird frei, wenn der Atomkern überschüssige Energie abgibt, die im Verlauf des radioaktiven Zerfalls entstanden ist.
Sie kann im Gegensatz zu den beiden aus Teilchen bestehenden Strahlungsarten nur durch Stoffe mit sehr hoher Dichte absorbiert werden, beispielsweise durch Blei.
γ-Strahlung ist für Lebewesen sehr gefährlich, weil die hohe Energie ausreicht, um Elektronen von anderen Atomen zu trennen, und somit gefährliche chemische Reaktionen herbeizuführen.
Massendefekt: Beim radioaktiven Zerfall geht ein kleiner Teil der Masse eines Atomkerns verloren, er wird in Energie umgewandelt. Dieser Prozess wird durch Albert Einsteins berühmte Formel E=m*c2 beschrieben. Hierbei steht E für die Energie, m für die Masse und c für die Lichtgeschwindigkeit.
Diese Umwandlung ist für die großen Energiemengen verantwortlich, die durch die gezielte Nutzung von Kernreaktionen für Waffen oder zur Energiegewinnung freigesetzt werden können. Nähere Einzelheiten zur Anwendung für Waffen lesen Sie in den Unterkapiteln "Little Boy" und "Atombombentests".
Ionisierende Strahlung: Radioaktive Strahlung wirkt ionisierend. Doch was bedeutet das genau? Ionen sind geladene Atome oder Moleküle, sie kommen in der Natur in großer Zahl vor. Eine ionische Verbindung, die sicherlich die allermeisten von Ihnen jeden Tag essen ist Kochsalz, Natriumchlorid. Kochsalz besteht aus Natriumatomen, die ein Elektron weniger besitzen, als im atomaren Zustand, bei den Chloratomen im Kochsalz ist es genau umgekehrt.
Die Tatsache, dass diese beiden Elemente im Kochsalz als Ionen vorliegen, ist für uns sehr vorteilhaft. Mit Sicherheit wollten Sie ihre Nudeln nicht mit einem Metall würzen, das bei Kontakt mit Wasser anfängt zu brennen, um dann eine ätzende Lauge zu bilden. Und selbst wenn Sie , (was nicht sehr wahrscheinlich ist,) das giftige und gasförmige Chlor gerne essen würden, wäre das praktisch kaum möglich.
Genau wie bei Natrium und Chlor macht die Anwesenheit oder das Fehlen von Ladungen auch bei anderen Verbindungen einen sehr großen Unterschied. Wenn also Elektronen durch radioaktive Strahlung zu Molekülen im Körper dazukommen, oder von ihnen getrennt werden, verändern sich die Eigenschaften dieser Moleküle drastisch. Sie können ihre eigentliche Funktion nicht mehr erfüllen und gehen gefährliche chemische Reaktionen ein.
Je nach Strahlendosis führt dies dann zu Krankheiten oder zum Tod, die Einzelheiten dazu lesen Sie im Unterthema Medizin.
1.2. Radioaktive Isotope
Wenn man sich das Periodensystem der Elemente anschaut, findet man dort einige Elemente, die ausschließlich in radioaktiver Form vorkommen. In den Periodensystemen in der Schule sind sie häufig mit einem Stern gekennzeichnet. Bei diesen Elementen ist die Anzahl der Protonen im Kern so hoch, dass die negative Ladung der Elektronen nicht ausreicht, um sie dauerhaft stabil bleiben zu lassen. Bekannte Beispiele für solche Elemente sind das Radium und, in unserem Fall besonders wichtig, der Uran.
Doch nicht alle Atome, die radioaktiv zerfallen, gehören zu diesen schweren Elementen. Wie unter 1.1. bereits beschrieben bestimmt die Anzahl der Protonen, zu welchem Element ein Atom gehört. Die Anzahl der Neutronen kann jedoch unterschiedlich sein, womit sich auch das Gewicht der Atome ändert. Atome, die sich in der Anzahl der Neutronen, nicht aber in der Anzahl der Protonen voneinander unterscheiden, nennt man Isotope.
Chemisch unterscheiden sich unterschiedliche Isotope in der Regel nicht voneinander, eine Ausnahme ist der Wasserstoff. Das Wasserstoffatom besteht normalerweise nur aus einem Proton und einem Elektron. Kommt noch ein weiteres Neutron hinzu, ist der Massenunterschied so groß, dass sich das auf die Reaktivität auswirkt. Bei größeren Atomen spielt dies jedoch keine bedeutende Rolle mehr.
Manche dieser Isotope unterscheiden sich jedoch dadurch, dass einzelne Isotope einer normalerweise stabilen Elementes, trotzdem radioaktiv zerfallen. Ein bekanntes Beispiel dafür ist das Kohlenstoffisotop 14C, welches für die Altersbestimmung organischer Materialien verwendet wird. In abgestorbenen Organismen werden keine neuen 14C-Atome mehr aufgenommen, so dass man mithilfe der Anzahl der zerfallen C-Atome bestimmen kann, wie alt das Material ist.
Einige dieser radioaktiven Isotope so wie 14C kommen natürlich vor, andere werden jedoch künstlich erzeugt. Beispielsweise durch die Kernreaktionen bei der Explosion einer Atombombe. Zu solchen künstlich erzeugten, radioaktiven Isotopen später mehr, zunächst kommen wir aber noch einmal auf eines der natürlichen, radioaktiven Elemente zurück, das Uran.
Wie bei anderen Elementen auch, gibt es beim Uran verschiedene Isotope. Sie sind alle radioaktiv, die Herstellung von Kernwaffen auf Uranbasis war allerdings in den vierziger Jahren nur mit dem Isotop 235U möglich.
235U ist spaltbar. Bei der Kernspaltung zerfällt es durch Einwirkung von Neutronen in ein Bariumatom und ein Kryptonatom. Zusätzlich werden noch zwei Neutronen freigesetzt, die weitere Urankerne spalten und damit eine Kettenreaktion auslösen. Diese Kettenreaktion ist für die große Menge an freigesetzter Energie bei einer Atombombenexplosion verantwortlich.
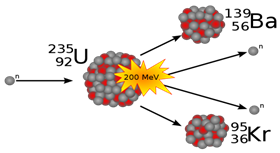
Bild: Wikipedia, (Kernspaltung)
Wenn die Spaltprodukte mit weiteren Atomen in Berührung kommen, entstehen neue Isotope, die häufig radioaktiv sind und nicht in der Natur vorkommen. Die Halbwertszeit dieser Isotope ist sehr unterschiedlich. Manche zerfallen nach wenigen Sekunden, während es bei anderen viele Jahre dauert, bis die Hälfte der Kerne zerfallen ist.
Besonders schädlich für den Menschen sind radioaktive Isotope von Elementen, die in ihrer natürlichen Form wichtig für den Körper sind, oder Elementen ähneln, bei denen dies der Fall ist. Drei wichtige Beispiel dafür sind 137Cäsium, 90Strontium und verschiedene radioaktive Iod-Isotope.
Da es sich bei Iod um ein Nichtmetall handelt, ist es wesentlich leichter flüchtig als metallische Elemente und kann somit schnell über einen weiten Bereich verteilt werden. Iod ist bekanntlich ein sehr wichtiges Element für die menschliche Schilddrüse. Freigesetzte radioaktive Iod-Isotope lagern sich genau wie stabile in der Schilddrüse ab und schädigen diese durch ihre Strahlung. Aus diesem Grund treten Krebserkrankungen der Schilddrüse bei Strahlenopfern sehr häufig auf, sowohl in Hiroshima als auch nach dem Reaktorunglück von Tschernobyl. Dies ist der Grund dafür, dass als Notfallmaßnahme für einen Reaktorunfall von den Behörden Iod-Tabletten eingelagert wurden. Die Idee dahinter ist, dass kein radioaktives Iod mehr in der Schilddrüse eingelagert wird, wenn dort bereits genügend nicht Radioaktives vorhanden ist.
Cäsium und Strontium sind beides keine Elemente, die vom Körper als notwendige Mineralstoffe aufgenommen werden. Allerdings ähneln die beiden Elemente von der Struktur her anderen Elementen, bei denen dies der Fall ist, was bei ihnen Ursache der gefährlichen Wirkung ist.
Cäsium ist ein Alkalimetall, das im Körper einfach positiv geladene Ionen bildet, die denen des Kaliums stark ähneln. Gelangt also radioaktives Cäsium in den Körper wird es genau wie das Kalium im gesamten Organismus verteilt, und kann dort seine schädigende Wirkung entfalten. 137Cäsium ist ein Isotop mit einer Halbwertszeit, die lang genug ist, um noch über Jahre hinweg eine Kontamination der Umwelt herbeizuführen.
90 Strontium, welches beim Zerfall der Bariumatome aus der Kernspaltung entsteht, ähnelt als Erdalkalimetall dem Calcium und wird im Körper statt Calcium in Knochen und Zähne eingebaut. Die Anwesenheit des radioaktiven Strontiums dort sorgt für Erkrankungen der Knochen und Zähne.
1.3. Maßeinheiten
Für die Messung von radioaktiver Strahlung werden verschiedene Einheiten verwendet.
Zur Messung der Aktivität einer radioaktiven Substanz wird die Einheit Becquerel (Bq) verwendet. Sie gibt die Anzahl der Kernzerfälle pro Sekunde an.
Die Aktivität einer Probe lässt sich mithilfe des einfachen Geigerzählers relativ gut nachweisen, da jeder Zerfall zu einem Knacken im Geigerzähler führt.
In der Vergangenheit wurde zur Messung der Aktivität auch die Einheit Curie verwendet. Ein Curie entspricht 37 Giga-Becquerel.
Die Energiedosis, die von einer radioaktiven Substanz abgegeben wird, wird in der Einheit Gray (Gy) gemessen. Bei einer Dosis von 1 Gy wird 1 Joule pro Kilogramm Masse aufgenommen.
Früher benutzte man für diese Messungen die Einheit Rad (rd). Ein Rad entspricht 0.01 Gy. Diese Einheit wird auf dem ausgestellten Geigerzähler, der gleichzeitig auch als Dosismessgerät dient, noch verwendet.
Mithilfe der ─quivalentendosis wird beschrieben, wie stark die Wirkung von ionisierender Strahlung auf den Körper ist. Die zu diesem Zweck verwendete Einheit ist Sievert (Sv). Da die Dosis der natürlichen Hintergrundstrahlung verhältnismäßig gering ist, wird zu ihrer Beschreibung häufig auf die Einheit Millisievert (mSv) zurückgegriffen.
In Deutschland liegt die natürliche, radioaktive Belastung je nach Bundesland zwischen 0.18 und 0.49 mSv pro Jahr.
Die Bewohner von Hiroshima waren direkt nach dem Atombombenabwurf teilweise einer einmaligen Dosis von 1-2 Sievert ausgesetzt, also ungefähr 2000 Mal so viel.
1.4. Zusammenfassung
Wie Sie sehen werden bei der Explosion einer Atombombe zahlreiche sehr unterschiedliche radioaktive Materialien freigesetzt. Die unter 1.2. beschriebenen Isotope sind nur eine kleine Auswahl dieser Substanzen.
Diese radioaktiven Isotope üben schädliche Wirkungen auf den menschlichen Körper aus, allerdings ist es nicht möglich, sie mit bloßem Auge von nicht radioaktiven Stoffen zu unterscheiden. Radioaktive Strahlung lässt sich nicht sehen, hören, riechen oder fühlen, letzteres gilt zumindest so lange wie die Dosis nicht hoch genug ist, um direkt Schäden anzurichten. Die unsichtbare Strahlung für den Menschen wahrnehmbar zu machen, ist allerdings dringend notwendig, denn nur so kann erkannt werden, wie weit die Kontamination vorgedrungen ist, und was für Maßnahmen ergriffen werden müssen, um weitere Schäden zu vermeiden.
Zur Messung von radioaktiver Strahlung wurden verschiedene Messgeräte entwickelt. Eines der ersten und bekanntesten dieser Messgeräte ist der Geigerzähler, der hier etwas ausführlicher beschrieben werden soll.
![]() Radioaktivität
Radioaktivität
![]() Geigerzähler
Geigerzähler
![]() Weitere Geräte
Weitere Geräte
![]() Bedeutung
Bedeutung
Letzte Änderung: 12.01.12 - DO